Paralisi Cerebrale Infantile (PCI) - DIPLEGIA - GAIT ANALYSIS
PARALISI CEREBRALE INFANTILE (PCI)
La paralisi cerebrale infantile (PCI) è definita come un gruppo di disturbi permanenti dello sviluppo del movimento e della postura, che causano una limitazione delle attività, attribuibili ad un danno permanente (non progressivo) che si è verificato nell’encefalo nel corso dello sviluppo cerebrale del feto, del neonato o del lattante. I disturbi motori della PCI sono spesso accompagnati da disturbi sensitivi, sensoriali, percettivi, cognitivi, comunicativi, comportamentali, da epilessia e da problemi muscoloscheletrici secondari (Rosenbaum et al., 2006). La PCI è dunque una condizione dovuta ad alterazioni del sistema nervoso centrale per cause pre-, peri- o post-natali, prima che se ne completi la crescita e lo sviluppo, estremamente eterogenea in termini di eziologia, tipo e gravità del disturbo stesso (Bax et al., 2005; Mutch et al., 1992; Bax 1964).
EZIOPATOGENESI
La PCI è causata da un danno al Sistema Nervoso Centrale (SNC), che può verificarsi durante la gravidanza, al momento del parto, o dopo la nascita. In base ad un criterio eziopatogenetico, che tiene conto del periodo in cui è avvenuto l’evento scatenante, i fattori determinanti di PCI possono essere classificati in pre-natali, peri-natali e post-natali (Krageloh-Mann,1995). I fattori che agiscono nel periodo pre-natale sono quei fattori che vanno ad interferire sullo sviluppo dell’embrione e del feto dal momento del concepimento al travaglio escluso, i fattori peri-natali sono quei fattori che intervengono dal momento del travaglio fino alla prima settimana di vita e i fattori post-natali sono quei fattori che si presentano nelle prime quattro settimane di vita (Fedrizzi, 2009).
Tra i fattori pre-natali troviamo anomalie cromosomiche, infezioni congenite, malformazioni cerebrali, tra i fattori peri e/o post-natali troviamo invece, nel nato a termine: emorragia intracerebrale, shock neonatale, sepsi o infezione del SNC, encefalopatia ipossico-ischemica. Nel nato pretermine invece: batteriemia o infezioni del SNC, edema o shock che hanno richiesto manovre di rianimazione, insufficienza d’organo e emorragia cerebrale di III o IV grado (Krageloh-Mann,1995).
Le manifestazioni cliniche dipendono dalla gravità ed estensione del danno e dalla sua localizzazione a seconda che causi lesioni al cervello, tronco cerebrale o al midollo spinale. La gravità dei segni e dei sintomi quindi, potrà variare da un lieve danno motorio sino al coinvolgimento di tutto il corpo ( Pavone, 2006), infatti il timing in cui la noxa patogena agisce sul cervello determina la localizzazione anatomica e il pattern della lesione, strettamente correlata con lo stadio di sviluppo del cervello (Haberg,1989;Krageloh- Mann,1995).
Le aree cerebrali manifestano diversa sensibilità agli agenti nocivi e ai danni in relazione allo stadio maturativo in cui si trovano: i preoligodendrociti e le cellule progenitrici sono più vulnerabili rispetto agli oligodendrociti maturi (Pavone,2006). Tra la 26° e la 34° settimana di vita intrauterina si ha una vulnerabilità selettiva della sostanza bianca periventricolare e quindi qualsiasi insulto cerebrale si verifichi in questa “finestra temporale” causerà leucomalacia periventricolare e diplegia spastica (Pavone,2006). La richiesta metabolica dei gangli basali fetali attorno alla 38° - 40° settimana di vita rappresenta un’altra vulnerabilità selettiva, se la noxa patogena agisce in questo periodo infatti creerà un altro danno cerebrale (Pavone,2006).
Nel primo e nel secondo trimestre, la patologia cerebrale è caratterizzata da anomalie dello sviluppo, che vanno dall’anencefalia alla polimicrogiria, spesso causate da disordini della migrazione dei neuroni e delle cellule gliali dallo strato germinativo alla corteccia. Nel terzo trimestre nel cervello avviene la formazione dei dendriti e delle sinapsi e inizia la mielinizzazione. In questa fase i patterns lesionali sono determinati in prevalenza da fattori vascolari: infatti all’inizio del terzo trimestre la zona periventricolare rappresenta una zona vascolare di confine estremamente vulnerabile e i patterns lesionali, dovuti a ipo–perfusione di origine ipossico – ischemica predominano in questa regione (Fedrizzi,2009).
Nelle paralisi cerebrali possiamo assistere a due tipi di danno, piramidale o extrapiramidale. In caso di danno piramidale, avremo un danno ai motoneuroni corticali superiori (1° motoneurone) con diminuzione degli input eccitatori e regolatori che dalla corteccia viaggiano attraverso i tratti reticolospinale e corticospinale per giungere ai motoneuroni del tronco cerebrale e del midollo spinale (2° motoneurone) che comandano i gruppi muscolari periferici. Questa diminuzione di input causa una diminuzione del numero effettivo di unità motorie e dunque porta a deficit di controllo muscolare e ipostenia.
Allo stesso modo però, la perdita degli input inibitori discendenti, mediati dai tratti reticolospinali, aumenta l’eccitabilità degli α-motoneuroni causando spasticità ( Pavone, 2006 ).
La spasticità è definita come un disordine motorio caratterizzato da un aumento velocità – dipendente della risposta muscolare allo stiramento e da un conseguente aumento dei riflessi osteotendinei ( Lance, 1980 ).
La spasticità determina delle modifiche strutturali del muscolo affetto con conseguenti alterazioni tempo-dipendenti delle proprietà muscolari, contrattili, tenso – elastiche, viscoplastiche: ne consegue l’insorgere di una catena di eventi che vanno dal ridotto allungamento muscolare, alle retrazioni tendinee, alle deformità ossee che caratterizzano la storia naturale del paziente spastico in età evolutiva (Fedrizzi, 2009).
In caso di danno ai sistemi extrapiramidali (spesso causato dall’iperbilirubinemia) invece, ci troveremo di fronte a disturbi del movimento quali atetosi, corea, distonia, rigidità (Pavone, 2006).
CLASSIFICAZIONE DELLE FORME CLINICHE DI PCI.
Classificare, in ambito clinico, significa individuare e suddividere i soggetti con manifestazioni cliniche simili, in gruppi. A seconda della finalità il criterio di classificazione può variare dal criterio eziologico, al criterio fisiopatologico, a quello sintomatico-descrittivo e infine a quello funzionale. Classificare può avere vari scopi alla luce dei quali si deve valutare la validità ed efficacia di una classificazione. Fin dai primi tentativi di classificazione, nelle PCI è stato utilizzato il criterio descrittivo fenomenologico, che va a raggruppare i casi in base alle caratteristiche e alla distribuzione dei sintomi. Il primo importante approccio fenomenologico alla classificazione delle PCI fu quello di Freud che nel 1897 le divise in (tabella 1.1) :
Emiplegia spastica
Diplegia cerebrale :
- Rigidità generalizzata (correlata con sofferenza durante il parto) Rigidità paraplegica (correlata con la prematurità)
- Dobbia emiplegia spastica
- Corea generalizzata e doppia atetosi
Tabella 1.1
Ai criteri di classificazione sintomatica usati da Freud, basati sulla descrizione dei sintomi neurologici (spasticità, discinesie, atassia ) e sulla loro distribuzione topografica (generalizzato, prevalente agli arti inferiori, ad un emisoma), si attennero negli anni seguenti anche altre proposte di classificazione (Phelps,1950; Ingram,1966).
Il fine di queste classificazioni era quello di un inquadramento a livello nosografico in assenza di conoscenze specifiche relative all’eziologia del danno e alle conoscenze dei meccanismi patogenetici del disordine. La classificazione sintomatica più recente e diffusa a livello internazionale, sia in Europa che negli Stati Uniti, è quella proposta da Hagberg nel 1975.
Questa è basata sugli stessi criteri descrittivi delle precedenti ( gruppi di sintomi e loro distribuzione topografica) , ma con la finalità di individuare quadri clinici per studi epidemiologici su ampie popolazioni e di definire l’eziopatogenesi di diversi quadri clinici.
Hagberg individua dunque 3 raggruppamenti ( tabella 1.2) di quadri clinici di PCI sulla base del sintomo che prevale :
|
Forme spastiche |
Emiplegia Diplegia Tetraplegia |
|
Forme atassiche |
Diplegia atassica Atassia congenita semplice |
|
Forme discinetiche |
Coreoatetosica Distonica |
Tabella 1.2
I quadri clinici vengono però definiti anche in relazione alla distribuzione topografica ossia :
- emiplegia: compromissione di un emisoma con prevalenza del deficit motorio o all’arto superiore o all’arto inferiore
- diplegia: indica una sindrome spastica in cui gli arti inferiori sono più compromessi degli arti superiori;
- tetraplegia: sindrome spastica in cui arti superiori e arti inferiori sono compromessi allo stesso modo o gli arti superiori risultano più compromessi degli arti inferiori;
- diplegia atassica: insieme alla spasticità prevalente degli arti inferiori ci sono segni atassici agli arti superiori come il tremore intenzionale;
- atassia congenita semplice: comprende quadri di atassia semplice senza componente spastica;
- coreoatetosi: sindrome discinetica caratterizzata da movimenti coreici, atetosici o coreoatetosici, coinvolgenti gli arti e il volto, con lieve ipotonia globale, che non comportano in genere una grave disabilità;
- forma distonica: è la forma discinetica più grave dominata da distonie, persistenza di riflessi primitivi, ipotonia del tronco grave con coinvolgimento dei distretti bucco-facciali e della faringe con importante disabilità funzionale.
In caso di presenza concomitante di segni spastici e segni discinetici, ci troviamo di fronte a delle forme miste, in questo caso l’appartenenza al gruppo delle sindromi spastiche o delle sindromi discinetiche è determinata dalla prevalenza e dall’entità del sintomo, ovvero se il sintomo discinetico è lieve, il caso viene attribuito alle sindromi spastiche, se invece è grave, il caso va direttamente tra le sindromi discinetiche . Una modifica della classificazione fornita da Hagberg , venne proposta nel 1989 da Michaelis. Si basò sempre su un approccio di tipo fenomenologico ma con una descrizione più dettagliata dei sintomi. Nelle sindromi spastiche vennero differenziate le forme emiparetiche dalle forme tetraparetiche e vennero suddivise in base alla distribuzione della spasticità (figura 1.1) :
leg dominated tetraparesis: indica una situazione in cui la spasticità è prevalente agli arti inferiori (equivalente della diplegia);

Figura 1.1: Classificazione delle sindromi tetraparetiche secondo Michealis ( Giorn. Neurops. Età Evol.,1989).
Three limb dominated tetraparesis: in questo caso indica una maggiore compromissione di 3 arti;
Side dominated tetraparesis: sarebbe l’equivalente dell’emiplegia, con maggiore compromissione di un emisoma;
Four limb tetraparesis: spasticità distribuita ai 4 arti;
Crossed dominated tetraparesis : con spasticità crociata, che interessa l’arto superiore e quello inferiore controlaterale.
Le monoparesi non vengono considerate in questa definizione in quanto rappresentano emiparesi a netta prevalenza di un arto, così come non vengono considerate neanche le paraparesi (espressione di patologie del midollo o genetiche) ne la forma ipotonica o aposturale che può essere osservata nei primi due anni di vita del bambino, prima dell’emergere di segni distonici o atassici.
Le principali categorie diagnostiche riportate dai vari modelli di classificazione sono descritte da G. Cioni e P. Paolicelli come segue:
Tetraparesi spastica: nelle tetraparesi il disturbo del tono e del movimento è di solito molto grave, raramente simmetrico, interessa gli arti superiori e inferiori e si rende manifesto fin dalla nascita. Lo sviluppo posturo- motorio presenta un ritardo importante, la prognosi per la deambulazione autonoma e per la manipolazione è sfavorevole. I disturbi visivi (agnosia
visiva, paralisi di sguardo, strabismo, riduzione dell’acuità visiva, ecc.) e della funzione uditiva sono frequenti. Molto spesso è presente epilessia che si manifesta, nella maggior parte dei casi, in forma generalizzata secondaria ( spasmi infantili, sindrome di Lennox-Gastaut, ecc. ). È spesso associato un quadro di insufficienza mentale, sia come conseguenza del danno neuropatologico corticale, sia per il precoce disturbo della motricità che rende difficile l’acquisizione delle principali tappe dello sviluppo psichico. Come conseguenza della spasticità si verificano contratture muscolari diffuse e deformità articolari e di assetto del rachide. Le lesioni anatomiche più frequenti, oggi osservabili anche in vivo grazie alle neuroimmagini specie alla risonanza magnetica (RMN), sono rappresentate da quadri diffusi di Leucomalacia Periventricolare o di sofferenza multicistica con atrofia cerebrale importante.
Diplegia Spastica: (che approfondiremo nel capitolo successivo) : nella diplegia spastica il disturbo del tono e del movimento interessa tutti e quattro gli arti ma in misura nettamente maggiore gli arti inferiori,è il quadro tipico del bambino nato fortemente pretermine, in cui più di frequente si trova una Leucomalacia Periventricolare. La tipologia del danno motorio è causata dalla contiguità fra le sedi delle lesioni malaciche e il decorso delle vie corticospinali destinate alla parte inferiore del corpo. L’ipertonia che interessa soprattutto i tricipiti surali e gli adduttori dell’anca, raramente si presenta prima del terzo – quarto mese di vita e talvolta più tardi. La motricità degli arti superiori è sufficientemente preservata; la prognosi per la deambulazione, anche senza ausili, è di solito favorevole. Vi è spesso un interessamento dei nervi cranici, frequente lo strabismo. Lo sviluppo dell’intelligenza e del linguaggio di solito non sono compromessi. L’epilessia è rara. Sono invece frequenti contratture muscolari e deformità articolari a livello dell’arto inferiore.
Emiplegia spastica: il disturbo del tono muscolare e del movimento volontario colpisce solo un emilato corporeo. L’interessamento può essere maggiore all’arto superiore o inferiore, spesso prevalentemente distale, ma talvolta anche prossimale. La prognosi per il raggiungimento della deambulazione autonoma è sostanzialmente sempre favorevole. I pazienti spesso presentano crisi convulsive, espressioni di un’epilessia parziale. Frequenti appaiono le alterazioni a carico dello schema corporeo e dell’organizzazione prassica e gnosica. Lo sviluppo dell’intelligenza può essere compromesso; quando all’emilato paretico corrisponde l’emisfero dominante, può manifestarsi un ritardo nello sviluppo del linguaggio. Nell’emilato paretico si sviluppano, in genere, già in età precoce, contratture muscolari e deformità articolari; il trofismo muscolare e osseo è spesso ridotto. Il correlato anatomico e neuroradiologico è per lo più rappresentato da cisti poroencefaliche isolate, lesioni della capsula interna, o anche lesioni periventricolari anche bilaterali o sofferenze più estese di un emisfero cerebrale.
Forma atassica: è di gran lunga la forma più rara di PCI. Prevale il disturbo della coordinazione dei movimenti (tremori, dismetria, adiadococinesia, ecc. ) e dell’equilibrio (atassia). Nei primi mesi di vita è caratteristica la presenza di una spiccata ipotonia che permane di solito anche in età successive; lo sviluppo psicomotorio è in genere ritardato; spesso è presente un nistagmo oculare di natura cerebellare. Talora possono essere associati sintomi di origine piramidale. Il linguaggio si sviluppa con ritardo a volte anche importante, la parola è scandita. Spesso è presente un deficit mentale. Sul piano anatomico queste forme sono associate a un danno del cervelletto e/o delle vie a partenza cerebellare dovuto in genere ad alterazioni malformative, della maturazione strutturale o a patologia infettiva. Meno frequentemente può derivare da una sofferenza ipossico-ischemica-emorragica perinatale.
Forma distonica: il disturbo motorio risulta da una disfunzione del sistema extrapiramidale, cui consegue un’alterazione della regolazione tonica. Il tono muscolare di fondo è ridotto in condizioni di riposo, mentre in situazioni di sollecitazione e di impegno motorio aumenta sensibilmente, provocando posture del tutto sovrapponibili a quelle che si osservano nelle sindromi spastiche. Quasi costantemente sono presenti ipercinesie involontarie, rapide e incoordinate, specie a carico della faccia e della lingua. Non infrequente è l’associazione con segni clinici di tipo piramidale ( forme miste ). La variabilità continua del tono colpisce anche i muscoli dell’apparato bucco- fonatorio per cui vi è un’alterazione dell’emissione della voce con linguaggio molto rapido e spesso incomprensibile. Lo sviluppo cognitivo è raramente compromesso. A livello encefalico si suppone che la lesione risieda nei nuclei della base; quando grave è identificabile con il cosidetto “status marmoratus”. Una volta per lo più associata all’ittero iperbilirubinemico da incompatibilità materno-fetale, questa forma di PCI rappresenta per lo più l’esito di un’asfissia perinatale grave nel neonato a termine.
Forma atetosica: si tratta di una sintomatologia conseguente a disfunzione del sistema extrapiramidale, prevalentemente a carico del nucleo caudato e del putamen. Il quadro clinico è dominato dall’ipotonia e dalla presenza di movimenti lenti, aritmici, continui di tipo polipoide che cominciano generalmente fin dai primi mesi di vita e spesso da movimenti rapidi, prossimali, coreici. Essi interessano la faccia, la lingua e l’estremità distale degli arti. Può coesistere la presenza di sintomi piramidali. Lo sviluppo dell’intelligenza non risulta solitamente molto compromesso; il linguaggio è disartrico. Quando il quadro è causato da iperbilirubinemia, spesso si associa una sordità percettiva.
Le classificazioni sintomatiche, si sono dimostrate estremamente utili in studi epidemiologici e di correlazione tra quadri clinici, tuttavia presentano dei limiti in quanto non prendono in considerazione gli aspetti funzionali del disordine motorio e risultano poco utili al fine di individuare una prognosi o un programma riabilititativo, così un gruppo di ricercatori americani (Palisano, Rosenbaum et al) , per ovviare a questo problema, ha proposto un approccio alla classificazione delle funzioni motorie nelle paralisi cerebrali infantili basato su concetti di disabilità e limitazione funzionale. Gli autori ritengono infatti che questo tipo di classificazione permette di migliorare la comunicazione tra professionisti e famiglie per diversi motivi: definire il livello di disabilità permette di determinare i bisogni del bambino e quindi decidere gli interventi terapeutici, costituisce un data-base per descrivere l’evoluzione delle sue abilità e fornisce un parametro di confronto fra il programma terapeutico e i suoi risultati. Essa infatti prende in considerazione il livello di disabilità rapportato all’età del bambino, e per ogni livello vengono descritte le abilità funzionali e le limitazioni separate per fasce di età. La validità e la affidabilità di questa classificazione sono state studiate su popolazioni di bambini con PCI in centri del Nord America (Wood, 2000; Palisano,2000) e la sua applicazione è risultata di valore prognostico nei confronti delle successive acquisizioni funzionali dei bambini seguiti.
Questa classificazione, meglio nota come Gross Motor Function Measure è così suddivisa:
LIVELLO I - Cammino senza restrizioni; limitazioni nelle più avanzate capacità grosso motorie.
- Prima del 2° anno di età: i bambini si muovono entro e fuori la posizione seduta, siedono a tappeto con entrambe le mani libere per manipolare gli oggetti. I bambini gattonano, si spingono per alzarsi e compiono passi aggrappati ai mobili. Camminano tra i 18 mesi e i 2 anni di età senza il bisogno di alcun ausilio.
- Dai 2 ai 4 anni: i bambini siedono sul pavimento con entrambe le mani libere per la manipolazione degli oggetti. I movimenti a tappeto e dalla posizione seduta a terra e nella posizione eretta vengono eseguiti senza l’assistenza di un adulto. I bambini camminano senza ausili come modo preferito di spostamento.
- Dai 4 ai 6 anni: I bambini salgono e scendono dalla sedia e vi siedono sopra senza il sostegno delle mani. Si alzano dal pavimento e scendono dalla sedia per stare in piedi senza la necessità di appoggiarsi agli oggetti. Camminano all’interno e all’esterno e salgono le scale. Affiorano le capacità della corsa e del salto.
- Dai 6 ai 12 anni: I bambini camminano all’interno e all’ esterno, salgono le scale senza limitazioni. Il bambini eseguono le abilità grosso motorie incluse la corsa e il salto ma la velocità, l’equilibrio e la coordinazione sono ridotte.
LIVELLO II- Cammino senza ausili; limitazioni nel cammino all’esterno e nella comunità.
- Prima del 2° anno di età: i bambini rimangono seduti sul pavimento ma possono aver bisogno di usare le loro mani come supporto per mantenere l’equilibrio. Strisciano sull’addome o gattonano. Possono spingersi in piedi e procedere aggrappati ai mobili.
- Dai 2 ai 4 anni: I bambini siedono in terra ma possono avere difficoltà nell’equilibrio quando entrambe le mani sono libere per manipolare gli oggetti. I movimenti entro e fuori dalla posizione seduta sono eseguiti senza l’assistenza di un adulto. I bambini si alzano in piedi tirandosi su una superficie stabile. Gattonano con un pattern reciproco, procedono aggrappandosi ai mobili e camminano usando un ausilio come metodo preferito di movimento.
- Dai 4 ai 6 anni: i bambini siedono su una sedia con entrambe le mani libere per manipolare gli oggetti. Si muovono dal pavimento alla stazione eretta e da seduti sulla sedia in piedi ma spesso richiedono una superficie stabile da spingere o per tirarsi su con le loro braccia. I bambini camminano senza il bisogno di ausili all’interno e per brevi tratti su terreni regolari all’esterno. I bambini salgono le scale aggrappandosi al corrimano ma sono incapaci di correre e saltare.
- Dai 6 ai 12 anni: i bambini camminano all’interno e all’esterno e salgono le scale aggrappandosi al corrimano ma sperimentano le limitazioni nel camminare su superfici irregolari e su pendii e nel camminare tra la folla o in spazi limitati. I bambini hanno al meglio solo una minima abilità nell’eseguire le funzioni grosso motorie come il correre o il saltare.
LIVELLO III – Cammino assistito con ausili: limitazioni al movimento all’esterno e alla vita sociale.
- Prima del secondo anno di età: i bambini stanno seduti a terra quando il bacino è sorretto, rotolano e strisciano sull’addome.
- Da 2 a 4 anni: i bambini mantengono la posizione seduta spesso “all’indiana” (sedendo con gambe e ginocchia flesse all’interno) ed è possibile che necessitino dell’assistenza di un adulto per assumere la posizione seduta. I bambini strisciano sull’addome o si appoggiano su mani e ginocchia strisciando (spesso con movimenti reciproci delle gambe) come loro primario metodo di movimento autonomo. Alcuni bambini si alzano su di una superficie stabile e percorrono brevi distanze. I bambini possono percorrere brevi distanze all’interno, usando ausili di movimento, con l’assistenza di un adulto per girare di lato e su se stessi.
- Da 4 a 6 anni: i bambini siedono su sedie normali ma possono aver bisogno di un ausilio pelvico o di un sostegno al tronco per ottimizzare le funzioni di manipolazione. I bambini si siedono e si alzano dalla sedia usando una superficie stabile per appoggiarsi o spingersi con le braccia. I bambini camminano, assistiti da un ausilio, su superfici piane e salgono le scale assistiti da un adulto; sono spesso trasportati quando viaggiano per lunghe distanze o all’esterno su superfici non piane.
- Da 6 a 12 anni: i bambini camminano sia all’esterno che all’interno su superfici piane e con ausili. Alcuni bambini salgono le scale aggrappandosi alla ringhiera. I bambini, dipende dalle funzioni degli arti superiori, possono manovrare una sedia a rotelle manuale o sono trasportati quando percorrono lunghe distanze o all’esterno su terreni non piani.
LIVELLO IV- Mobilità autonoma con limitazioni: i bambini sono trasportati o usano ausili ad energia all’esterno e nella comunità.
- Prima dei 2 anni: i neonati hanno il controllo del capo ma è richiesto il sostegno del tronco nella posizione seduta sul pavimento. Possono rotolare da supini e da proni.
- Dai 2 ai 4 anni: i bambini siedono sul pavimento se vi vengono messi ma non sono capaci di mantenere l’allineamento e l’equilibrio senza il sostegno delle loro mani. Frequentemente richiedono un ausilio adattativi per stare seduti e in piedi. Il movimento autonomo per brevi distanze ( dentro una stanza) è raggiunto attraverso il rotolamento, lo striscio sullo stomaco o il gattonamento senza movimenti reciproci delle gambe.
- Dai 4 ai 6 anni: i bambini siedono su una sedia ma necessitano di un ausilio adattativi per il controllo del tronco e per massimizzare la funzionalità delle mani. Siedono e scendono dalla sedia con l’assistenza di un adulto o di una superficie ferma da spingere o tirare con le loro mani. I bambini al meglio possono camminare per brevi distanze con un walzer e con la supervisione di un adulto ma hanno difficoltà a girare e a mantenere l’equilibrio su ogni superficie. Vengono trasportati nella comunità; possono raggiungere la mobilità autonoma usando una carrozzina elettrica.
- Dai 6 ai 12 anni: i bambini possono mantenere i livelli di funzionalità raggiunti prima dei 6 anni o contare più su una mobilità “su ruote” a casa, a scuola e nella comunità. Possono raggiungere la mobilità autonoma usando una carrozzina elettrica.
LIVELLO V- Il movimento autonomo è severamente limitato anche con l’uso di tecnologia di assistenza.
- Prima dei 2 anni: le menomazioni fisiche limitano il controllo volontario del movimento. I neonati sono incapaci di mantenere contro gravità le posture del capo e del tronco da proni e da seduti. Richiedono l’intervento di un adulto per rotolare.
- Dai 2 ai 12 anni: la menomazioni fisiche restringono il controllo volontario del movimento e l’abilità nel mantenere la posizione contro gravità del capo e del tronco. Tutte le aree di funzionalità motoria sono limitate. Le limitazioni funzionali nello stare seduti o in piedi non sono completamente compensate attraverso l’uso di ausili adattativi e tecnologia d’assistenza. Al livelli V i bambini non hanno risorse per una mobilità indipendente e vengono trasportati. Alcuni bambini raggiungono il movimento autonomo usando una carrozzina elettrica con ampi adattamenti.
Palisano R, Rosenbaum P, Walter S, Russel D, Wood E, Galuppi B (1997)
Development and reliability of a system to classify gross motor function in children with cerebral palsy.
Dev Med Child Neurol 39: 214-223
Definire il livello di disabilità permette di avere presente i deficit e le necessità del bambino e, di conseguenza, progettare un intervento terapeutico mirato ed individualizzato.
Anche la disabilità funzionale degli arti superiori è stata classificata nel corso degli ultimi anni dal gruppo svedese coordinato da Eliasson (2005): è stata messa a punto una scala di classificazione del livello di disabilità degli arti superiori, definita Manual Ability Classification System (MACS) secondo criteri analoghi alla GMCS, con 5 livelli di gravità di limitazione funzionale dal più lieve (livello I) in cui si rilevano solo anomalie di atteggiamenti ma la funzione è conservata, al livello V in cui la funzione è quasi assente (Figura 1.2).

Figura 1.2 : Eliasson et al., 2006; Traduzione italiana a cura di R. Caluri, E. Sicola e G. Sgandurra.
Il problema della classificazione delle PCI è stato infine recentemente ridiscusso dal gruppo internazionale che ha ridefinito anche il termine di Paralisi Cerebrale. Questo gruppo di esperti, nel corso di un WorkShop tenutosi a Bethesda nel 2004 ha rivisto i concetti di definizione di classificazione di PCI e li ha resi omogenei per una audience internazionale.
Dal momento che la nuova definizione copre uno spettro di quadri clinici estremamente ampio è risultato utile categorizzare ulteriormente i soggetti con PC in gruppi o classi.
A differenza degli schemi di classificazione precedenti, lo schema di classificazione attuale ha preso in considerazione caratteristiche addizionali che contribuiscono in maniera sostanziale alla comprensione e al trattamento del disordine.
Il nuovo schema di classificazione delle Paralisi Cerebrali è stato elaborato sulla base delle recenti acquisizioni delle neuroscienze, in particolare nell’ambito della valutazione quantitativa delle neuro immagini e degli aspetti clinici delle paralisi cerebrali. La classificazione prende in considerazione 4 dimensioni che sono : anomalie motorie, disordini concomitanti, gli aspetti anatomici e delle neuro immagini, e i fattori eziologici e il periodo in cui hanno causato il danno.
La prima dimensione (riferita alle caratteristiche delle anomalie motorie) analizza sia la natura e la tipologia del disordine come alterazione del tono o dei movimenti ( spasticità, distonia, atetosi, atassia) che la limitazione funzionale motoria indotta dal disordine. Questa limitazione a carico degli arti inferiori e superiori deve essere classificata usando le scale funzionali attualmente disponibili come la Gross Motor Function Classification System (GMFCS) e la Manual Ability Classification System (MACS).
La seconda dimensione prende in considerazione gli altri disordini che spesso accompagnano il quadro di paralisi cerebrale e possono portare a limitazioni funzionali a volte anche più gravi di quelle dovute al disturbo motorio stesso. Questi disordini, come le alterazioni muscolo-scheletriche, i disordini sensoriali, intellettivi, attentivi e comportamentali devono sempre essere classificati con parametri quantitativi e la loro interferenza con la capacità di partecipazione e con il ruolo sociale deve essere valutata.
La terza dimensione si riferisce in primis alla distribuzione anatomica del disordine e quindi alle diverse parti del corpo che sono state coinvolte.
La quarta dimensione della classificazione sottolinea la necessità di individuare le cause e l’epoca in cui si è verificato l’insulto che ha portato all’instaurarsi del danno: ciò è spesso difficile perché è sempre più evidente che la paralisi cerebrale può risultare da un’interazione di molteplici fattori di rischio, molto spesso non identificabili.
DIPLEGIA
Non c’è molta uniformità tra le diverse scuole riabilitative, uno stesso bambino può essere considerato diplegico per una scuola e tetraplegico con coinvolgimento maggiore degli arti inferiori per un’altra. Queste differenze non sono comunque rilevanti per il terapista che deve considerare le potenzialità del bambino, indipendentemente dalla diagnosi, facendo un’osservazione delle abilità funzionali, delle strategie messe in atto per risolvere un compito e delle eventuali componenti deficitarie.
Il bambino diplegico mosta un deficit localizzato in particolare a livello degli arti inferiori e del bacino che andrà ad influenzare i distretti corporei a monte.
La maggior parte dei bambini diplegici presentano una storia di prematurità (Hagberg, 1989). Il danno neurologico d’elezione per questo quadro è rappresentato dalla Leucomalacia Periventricolare (LPV) che interessa la sostanza bianca, che oltre al deficit motorio, va a causare anche difficoltà a livello dell’esplorazione visiva, dello schema corporeo, dell’orientamento visuo – spaziale e di stereognosi.
La LPV predomina come aspetto patogenetico in bambini che presentano un’età gestazionale compresa tra le 28 e le 36 settimane (Hagberg,1993). Volpe attribuisce come causa primaria della LPV l’ipotensione sistemica e da a 3 fattori un ruolo fondamentale:
- Le strutture vascolari periventricolari rendono il pretermine estremamente vulnerabile a ischemia cerebrale;
- Il pretermine non presenta meccanismi di regolazione vasale e quindi la circolazione dipende in maniera passiva dalla pressione arteriosa;
- Le cellule gliali si trovano in fase attiva di differenziazione e mielinizzazione e sono per questo maggiormente vulnerabili.
Secondo Volpe, la relazione tra gli aspetti morfologici della LPV e la diplegia spastica è chiara : la compromissione motoria che prevale agli arti inferiori rispetto agli arti superiori, è dovuta dal coinvolgimento della sostanza bianca nelle aree laterali e dorsali dei ventricoli laterali che vanno a interrompere i tratti corticospinali che, dalla corteccia motoria arrivano agli arti inferiori.
ASPETTI CLINICI DELLA DIPLEGIA SPASTICA
Durante l’esame obiettivo del neonato, risulta estremamente importante osservare la motilità spontanea che, nel pretermine, può presentare alterazioni qualitative, come un repertorio povero in particolare modo agli arti inferiori, o dei movimenti sincroni-crampiformi.
I segni neurologici che si rilevano nel bambino con diplegia spastica sono:
- Alterazioni del forza e della motilità volontaria: nei casi lievi prevalgono distalmente a livello degli arti inferiori, con assenza di movimenti attivi di flesso – estensione delle dita e riduzione della flessione dorsale del piede; nei casi più gravi coinvolgono anche i distretti prossimali del ginocchio e dell’anca, con riduzione dei movimenti isolati e presenza di sinergie stereotipe di flesso – estensione ed adduzione. Le alterazioni di forza e motilità volontaria sono sempre presenti, anche se in misura variabile al tronco e agli arti superiori e, anche qui, il deficit prevale distalmente con riduzione della motilità intrinseca delle dita e dell’opposizione del pollice e con limitazione della fluidità e rapidità nei movimenti di prono – supinazione e di flesso – estensione del polso. A differenza delle forme tetraplegiche (four – limb), nella diplegia spastica non c’è coinvolgimento dei distretti bucco – facciali e della muscolatura fonatoria;
- Alterazioni del tono muscolare: sono rappresentate prevalentemente dalla spasticità, con distribuzione prevalente agli arti inferiori, ma presente, anche se, in misura minore al tronco e agli arti superiori. La spasticità a livello degli arti inferiori interessa di più la muscolatura estensoria e adduttoria rispetto alla muscolatura flessoria, condizionando in questo modo i tipici pattern posturali di incrociamento degli arti inferiori che si riscontrano nelle posture antigravitarie e nel cammino. Nel bambino pretermine, nei primi mesi di vita, le alterazioni del tono spesso assumono il carattere dell’ipotonia prevalente al tronco o delle fluttuazioni toniche in relazione alle variazioni posturali, e la spasticità emerge solo nel secondo anno di vita;
- Alterazioni sensoriali: le lesioni caratteristiche della diplegia spastica interessano le radiazioni ottiche e quindi le vie ottiche retrochiasmatiche che portano le informazioni alla corteccia striata, determinando perciò alterazioni dell’input visivo periferico di entità variabile in relazione all’estensione della lesione. Oltre alle vie ottiche, le alterazioni della sostanza bianca possono determinare modificazioni dei circuiti occipito-parieto-temporali che costituiscono le vie di collegamento fra le zone associative deputate al riconoscimento delle caratteristiche formali degli oggetti e quelle deputate al riconoscimento della localizzazione spaziale degli oggetti, con conseguente presenza di disordini visivi centrali che comportano difficoltà di discriminazione visuopercettiva e, successivamente, problemi di apprendimento scolastico.
- Alterazioni biomeccaniche dei muscoli e deformità articolari: la spasticità comporta l’instaurarsi di alterazioni della struttura muscolare che perde la normale elasticità ed estensibilità e porta l’instaurarsi di contratture, tensioni muscolari e, con il graduale accrescimento delle strutture scheletriche, a deformità articolari. Ciò si verifica abitualmente nel bambino diplegico, anche nelle forme più lievi, proprio per il concorrere di cause diverse. Le tensioni in generale si rilevano già nei primi 2 anni di vita a carico della muscolatura dei flessori e adduttori dell’anca e negli estensori del piede, successivamente coinvolgono gli ischiocrurali e il quadricipite e condizionano in modo rilevante le posture e la funzionalità del cammino. Le deformità articolari si sviluppano in genere dopo il 2° anno di vita: la più precoce interessa l’articolazione dell’anca, ove il valgismo dei colli femorali può portare gradualmente all’instaurarsi di sublussazioni e l’antiversione dei colli femorali ad un’intrarotazione di tutto l’arto inferiore. Anche l’equinismo del piede con componenti più o meno marcate di varismo si rileva in genere entro i primi 3 – 4 anni di vita, mentre le deformità del ginocchio si manifestano in genere tra i 4 e i 6 – 7 anni.
EVOLUZIONE NATURALE DEL QUADRO MOTORIO
L’evoluzione naturale dal punto di vista motorio del bambino diplegico è stata studiata da P. Giannoni e L. Zerbino che l’hanno così descritta nel libro “Fuori Schema”.
Il bambino diplegico, se messo in posizione supina (figura 1.3) si relaziona facilmente con la mamma, aggancia visivamente ( se non presenta problemi oftalmologici) e risponde a eventuali stimoli esterni. Presenta uno sgambettio che a prima vista sembra normale ma che in seguito ad una attenta osservazione mostra movimenti limitati e poco variabili soprattutto a livello delle caviglie e delle dita dei piedi. Lo sgambettio non risulta fluido, armonico e vivace, gli arti inferiori si flettono e abducono ma lo schema ripetitivo ricorda la Figura 1.3 : il bambino diplegico in posizione supina. (Fedrizzi,2009) sinergia flessoria e, nella fase di estensione, un arto è sempre un po’ più flesso rispetto all’altro cosa che rivela, a monte, un disallineamento del bacino che porta a un avvicinamento tra il cingolo scapolare e il cingolo pelvico da un lato e che facilita un progressivo atteggiamento in intrarotazione dell’arto meno flesso. In questa fase il controllo del capo e l’uso degli arti superiori sembrano normali in quanto non sono ancora molto coinvolti in compiti antigravitari. Il capo risulta infatti libero di muoversi e gli arti superiori possono giocare sulla linea mediana nonostante uno risulti meno competente dell’altro a causa dell’alterato rapporto tra i due cingoli.

Prono il bambino rotola dal lato in cui i cingoli sono più vicini tra loro, facendo partire il movimento dal capo e dal cingolo scapolare che risultano più mobili rispetto alla parte inferiore del corpo. La gamba segue con movimenti poco selettivi. È in grado di appoggiarsi sugli avambracci, ma in futuro presenterà difficoltà ad appoggiarsi sulle mani e a spingersi sulle braccia estese a causa della mancanza di una buona estensione a livello delle anche. Gli arti inferiori presentano un atteggiamento asimmetrico per il disallineamento della parte prossimale. Non esegue il pivoting a causa sempre della mancata estensione delle anche e dell’abduzione estensione degli arti inferiori ma striscia facendo perno sugli avambracci e utilizzando quindi una strategia che comporta un eccessivo coinvolgimento della parte superiore in atteggiamento globale flesso. Per poter giocare il bambino si mette sul fianco andando ad accentuare l’atteggiamento di globale asimmetria.
Raggiunge la posizione seduta in tempi apparentemente normali, ma non risulta in grado di modulare la retro – anteroversione del bacino con la colonna. Mentre da prono non mostra una adeguata estensione delle anche, da seduto non raggiunge una adeguata flessione cosa che compromette sia l’abduzione degli arti inferiori, sia il balance. In long sitting, usa le mani per tenersi a qualcosa in modo da stabilizzare la postura e allargare la base di appoggio. Permangono l’obliquità del bacino e l’avvicinamento tra i due cingoli cosa che fa evidenziare sempre di più il “colpo di vento” degli arti inferiori e il carico più accentuato su un’anca.
In ginocchio, la parte superiore del corpo viene sempre maggiormente reclutata in ogni iniziativa di movimento: per avere finalmente il tronco e le braccia libere il bambino si siede tra i talloni, creando una base di appoggio larga su cui la colonna può muoversi con ampiezza. Il disallineamento del bacino influenza l’atteggiamento delle gambe flesse: un arto è intraruotato e l’altro extraruotato.
La mancata estensione delle anche non permette al bambino di rimanere a lungo in ginocchio con un buon raddrizzamento.
Il bambino si sposta a balzi, aiutandosi con le braccia in uno schema molto grossolano.
Per il bambino con diplegia, risulta troppo difficile usare un passaggio in half – kneeling per mettersi in piedi a causa dei movimenti poco selettivi a livello delle anche, così preferisce usare le braccia per “aggrapparsi” a qualcosa, trascinando dietro la parte inferiore del corpo. Una volta in piedi, il carico sugli arti inferiori si differenzia, un arto ha funzione di sostegno, con flessione dell’anca e appoggio a tutta pianta ( ampio angolo di flessione dorsale della tibiotarsica per via della contrazione del tricipite surale), mentre l’altro arto risulta più flesso e intraruotato con piede equino che tocca il terreno solo con l’avampiede e ha la funzione principale di procurare una base d’appoggio più ampia. Durante il cammino i due arti si scambiano i compiti in maniera veloce e senza precisione per rincorrere il baricentro. Il balance è dato dalla parte superiore del corpo, gli arti superiori infatti si abducono o si portano in avanti mentre il bacino è bloccato in antiversione con una iperlordosi a livello lombare. Le parti periferiche non diventano mai dei buoni strumenti per ricevere informazioni sensoriali perché impegnate in maniera diversa: i piedi non possono avere un buon contatto con il terreno ed adattarvisi correttamente, gli arti superiori non sono in grado di eseguire movimenti raffinati in quanto impegnati in funzioni più grossolane, quali bilanciare il corpo, sostenersi, aggrapparsi. Le eventuali difficoltà visuo-percettive primarie aumentano ulteriormente perché la testa non rimane indipendente ma è coinvolta nei compensi funzionali necessari per compiere un movimento. L’impiego progressivo degli arti superiori in funzioni di sostegno impoverisce l’acquisizione di competenze raffinate di tipo prassico e gnosico.
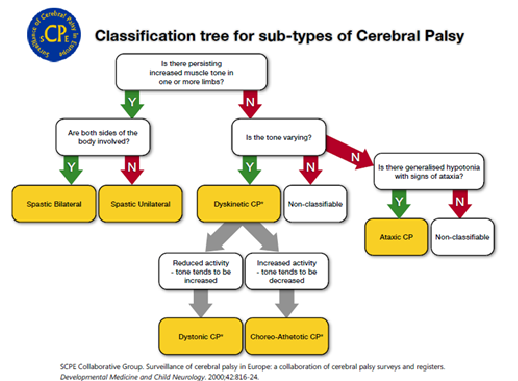
CARATTERISTICHE DEL CAMMINO NELLE VARIE TIPOLOGIE DI DIPLEGIA
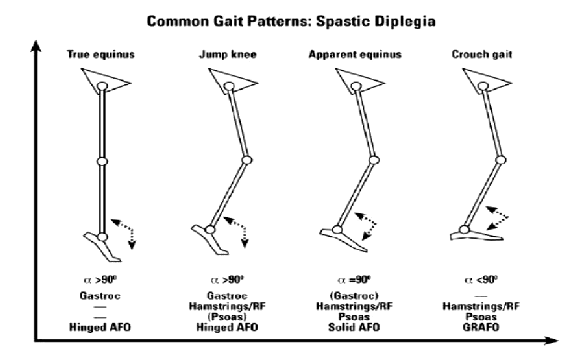
Figura 1.3
- True equinus: quando il bambino con diplegia inizia a camminare con o senza assistenza, la spasticità del polpaccio è frequentemente dominante e ne deriva un passo del tipo “vero equino” con caviglia in flessione plantare per tutta la fase di carico ( stance phase) e anche e ginocchia estese. Questa andatura potrebbe essere nascosta dallo sviluppo del recurvato a livello delle ginocchia. Il paziente in questo caso si presenta con piede piatto e ginocchio in recurvato ( Miller et al, 1995). L’equinismo è reale, ma nascosto. Il alcuni bambini con diplegia, l’andatura del tipo “vero equino” rimane per tutta l’infanzia e se sviluppano una retrazione possono eventualmente ottenere benefici da un allungamento isolato del muscolo gastrocnemio. La persistenza di questo tipo di pattern è insolita e si vede solo in una piccola minoranza di bambini con diplegia, mentre risulta più comune in bambini con spasticità secondaria a lesioni spinali.
- Jump gait ( con o senza ginocchio rigido): questo tipo di andatura è veramente comune da vedere nei bambini con diplegia, con coinvolgimento più prossimale, con spasticità a livello dei muscoli posteriori della coscia e flessione delle anche sommata alla spasticità del polpaccio. La caviglia si presenta in equino, il ginocchio e l’anca sono flessi e c’è un’inclinazione pelvica anteriore con incremento della lordosi lombare. C’è spesso un ginocchio rigido a causa dell’attività del retto femorale durante la fase oscillante del passo ( swing phase). Quanto detto fino ad ora è la descrizione della “jumpgait” data da Sutherland and Davids, sebbene Miller et al descrive la caviglia come neutrale in questo pattern di cammino. Boyd et al preferiscono usare il termine “equino apparente” per descrivere anche e ginocchia flesse e piede plantigrado.
- Apparent equinus ( con o senza rigidità del ginocchio): con la crescita del bambino e l’aumento di peso, può accadere che il muscolo del polpaccio e i muscoli che si occupano dell’estensione plantare-estensione ginocchio, diventino meno competenti. L’equinismo potrebbe quindi diminuire gradualmente all’aumentare della flessione di anca e ginocchio ( Rab, 1991; Sutherland and Davis, 1993; Molenaers et al,2001). C’è di frequente uno stadio di “equinismo apparente” dove si nota ancora che il bambino cammina sulle punte e una osservazione superficiale dei dati della gait analisys potrebbe erroneamente concludere che l’equinismo è reale, anche se di fatto non è vero. La cinematica del piano sagittale ci mostra infatti che la caviglia si trova entro il range normativo di dorsiflessione, ma le anche e le ginocchia presentano una eccessiva flessione per tutta la fase portante del ciclo del passo. In questi bambini il trattamento dovrebbe essere concentrato più a livello prossimale dove i muscoli posteriori della coscia e gli ileopsoas potrebbero beneficiare di un allungamento muscolotendineo.
- Crouch gait ( con o senza rigidità del ginocchio) : questo tipo di andatura è definito da un’eccessiva dorsiflessione della caviglia combinata con un’eccessiva flessione di ginocchio e anca. È un pattern di cammino che fa parte della storia naturale dei disordini del passo in bambini con una diplegia molto severa e nella maggior parte dei bambini che presentano una quadriplegia spastica. Purtroppo, la causa più comune di crouch gait nei bambini con diplegia spastica è l'allungamento isolato del tendine del tallone nel bambino più piccolo. Una volta eseguito l’allungamento del tendine di Achille, se la contrattura/spasticità dei muscoli posteriori della coscia e degli ileopsoas non viene riconosciuta e trattata in maniera adeguata, ci sarà un rapido incremento della flessione di anca e ginocchio. Il risultato è un’andatura poco fluida e dispendiosa dal punto di vista energetico seguita da dolore anteriore del ginocchio e patologie della rotula in età adolescenziale.
In poche parole, nei pazienti che presentano un’andatura di tipo “ true equinus” osserviamo un cammino in punta di piedi, a causa della spasticità del gastrocnemio che induce una situazione in cui piede e tibia formano tra loro un angolo >90°.
Nel caso di “jump gait”, oltre alla spasticità del gastrocnemio, l’articolazione del ginocchio è inficiata da una spasticità a livello degli hamstring (muscoli flessori del ginocchio ed estensori dell’anca) e del retto femorale. Questo comporta una flessione costante del ginocchio e un angolo tra piede e tibia, come nel caso dell’andatura “true equinus”, >90°, con una dissipazione elevata di potenza e una non adeguata propulsione nel cammino. La considerazione riguardo l’angolo tra tibia e piede, risulta determinante per distinguere la condizione di “jump gait” da quella di “ apparent equinus”. In quest’ultima andatura infatti, l’angolo tra piede e tibia è pari a 90° e in aggiunta alle spasticità già considerate, vi è quella relativa agli ileo-psoas, muscoli flessori dell’anca.
Infine il cammino in “crouch” è caratterizzato da un’eccessiva flessione di anca e ginocchio ed è uno dei più comuni pattern di cammino di bambini con PC bilaterali. In questo tipo di andatura, non troviamo spasticità del gastrocnemio, ma degli hamstrings, del retto femorale e dell’ileopsoas con un maggiore stato di sforzo da supportare a livello articolare. Questa situazione risulta molto dispendiosa a livello energetico per il mantenimento della postura eretta e del cammino.
ARTI SUPERIORI NEL CAMMINO DEL BAMBINO CON DIPLEGIA
Durante il cammino, gli arti superiori non rimangono indifferenti, bensì sembrano avere due obiettivi principali:
- controllare l’equilibrio;
- Ottimizzare il dispendio di energia.
Meyns et al hanno studiato infatti, che nelle paralisi cerebrali, i bambini, fanno affidamento sugli arti superiori per compensare all’equilibrio precario dovuto alla spasticità dei diversi muscoli degli arti inferiori che causano un appoggio non stabile, e dunque per mantenere il balance durante il cammino così come fanno i bambini che stanno appena imparando a camminare.
Diversi studi, hanno poi dimostrato che, impedire l’oscillazione degli arti superiori durante il passo, cambia l’andatura anche negli adulti sani, in particolar modo per quanto riguarda la cadenza e la coordinazione tra i due arti inferiori, non dovremmo stupirci quindi delle difficoltà che incontrano i bambini diplegici nel cammino, dal momento che gli arti superiori vengono usati, come detto sopra, per avere maggior equilibrio e di conseguenza si trovano nella situazione di non poter effettuare i normali movimenti di oscillazione.
Negli studi fatti da M.Galli, G. Albertini e altri, è stato comparato un gruppo di bambini diplegici e un gruppo di bambini sani, ed è risultato che i pazienti diplegici camminano incrementando il range di movimento a livello del torace e la spalla, durante il contatto iniziale, risulta più abdotta rispetto al gruppo di controllo, ma non in maniera significativa. Il gomito invece viene tenuto più flesso, rispetto al gruppo controllo, per l’intero ciclo del passo. Questa maggiore flessione a livello del gomito, rappresenta la strategia attuata dai bambini con diplegia per migliorare l’equilibrio.
GAIT ANALYSIS
Negli ultimi decenni l’analisi quantitativa strumentale del movimento umano ha subito una trasformazione radicale. A partire dai primi anni 80, grazie alla disponibilità di tecnologie innovative per l’acquisizione non invasiva e per l’elaborazione rapida di parametri motori biomeccanici e mioelettrici in soggetti liberi di muoversi, è stato possibile estendere l’analisi del movimento a compiti sempre più complessi, eseguiti in condizioni molto vicine a quelle naturali. Questo processo si è accompagnato all’espansione dell’area di studio dell’ambito della sperimentazione di base a quello della ricerca clinica e successivamente a quello dell’applicazione di routine, con particolare riferimento alle patologie del sistema scheletrico, muscolare e nervoso. Tra i compiti motori studiati attraverso le nuove metodiche, il cammino occupa certamente uno dei primi posti, sia per la sua evidente rilevanza nell’autonomia individuale, che per la relativa maggior semplicità di un’analisi applicata ad un evento motorio ciclico. (Fedrizzi, 2009) Qualsiasi forma di attività fisica (AF), quindi anche la deambulazione, richiede un dato dispendio metabolico (DM). L’AF comprende sia lo sviluppo di forza isometrica e sia qualsiasi forma di movimento. Tra AF e DM, si tratta quindi delle due facce della stessa medaglia. Le branche della biomedicina che si occupano dello studio di AF e DM sono, rispettivamente, la biomeccanica e la bioenergetica (di Prampero, 1985; 1986) Corretta postura ed equilibrio risultano fondamentali per lo svolgimento dell’attività fisica. La BIOMECCANICA si occupa più specificamente di (Winter, 1979):
- cinematica, cioè lo studio descrittivo del movimento;
- antropometria, cioè lo studio delle variabili antropometriche (dai quali valori non può prescindere alcun successivo utilizzo dei dati cinematici);
- cinetica (o dinamica), cioè lo studio delle cause e delle conseguenze del movimento;
- energia, lavoro e potenza meccaniche relative all’AF;
- meccanica muscolare;
- elettromiografia (di superficie).
PARAMETRI SPAZIALI
Sono le misure utilizzate per descrivere la posizione del piede sul terreno. Si dividono in:
- “stride length” o “Lunghezza del passo”: distanza tra due posizioni consecutive dello stesso piede. Viene calcolato come la somma della lunghezza del passo destro e della lunghezza del passo sinistro e, in generale, è espressa in metri. All’interno dei quadri patologici, spesso accade che le "Lunghezze del passo destro" e "Lunghezza del passo sinistro" abbiano misure diverse l'una dall'altra. Nel caso in cui il piede sinistro sia nella posizione anteriore per eseguire un passo e il piede destro sia portato lateralmente al piede sinistro invece di essere allineato con esso, la lunghezza del passo sarà zero. Quando un piede non raggiunge l'altro passo, l’arto raggiungerà una lunghezza negativa.
- “step width” o "Larghezza di passo": distanza tra la linea che rappresenta l'asse di ciascun piede (linea che passa dal centro di alluce e tallone). È un parametro che si esprime in millimetri.
Queste misure sono tarate in base alle misure del soggetto.
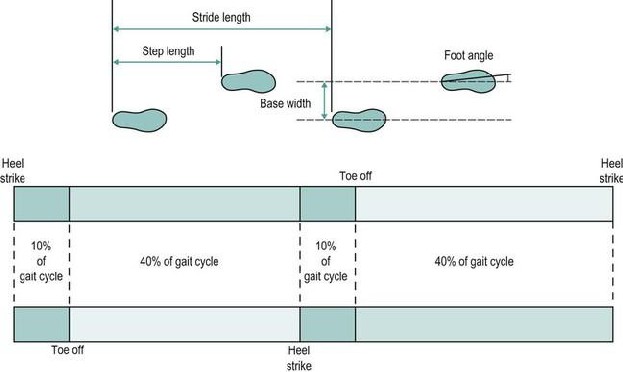
Figura 1.4
PARAMETRI TEMPORALI.
- "cadenza": numero di passi in un intervallo di tempo definito. Di solito l'unità di misura è passi / minuto, che non è conforme al Sistema Internazionale (IS); un'altra unità di misura che è accettabile è passi / s. La relazione tra cadenza e durata del ciclo del passo è espressa da:
- Ciclo del passo (s)= 120/ cadenza [passi/min]
- “velocità media di cammino”: quanta distanza viene percorsa in un intervallo di tempo, espresso in m / s. È il prodotto della cadenza e della lunghezza del passo e in alternativa può essere calcolato dalla cadenza e dalla lunghezza del passo come segue:
- Velocità (m/s) = lunghezza del paso (m) x la cadenza (passi/min)/120
PARAMETRI CINEMATICI
Cinematica: quella sezione della meccanica che descrive il movimento dei corpi indipendentemente dalle cause che li producono, cioè indipendentemente dalle forze, e che si fonda essenzialmente sui concetti di spazio e di tempo. La definizione di cinematica può essere espressa come geometria del movimento analizzata sui tre piani dello spazio.
Con il termine "cinematica assoluta" ci si riferisce quando al movimento descritto rispetto ad un sistema di riferimento assoluto, (es. il sistema di riferimento del laboratorio), mentre "cinematica relativa" è quando il movimento di un segmento corporeo è descritto rispetto ad un altro segmento corporeo.
Per capire la cinematica del cammino dobbiamo introdurre alcune definizioni:
- Sistema di coordinate: è un insieme di tre vettori mutuamente ortogonali;
- Sistema di coordinate del laboratorio: è un sistema di coordinate che rimane fisso nello spazio;
- Sistema tecnico di coordinate: è il sistema di coordinate che proviene dai marcatori posizionati sui segmenti corporei; questo sistema di coordinate si muove insieme ai segmenti corporei;
- Sistema anatomico di coordinate: è un sistema di coordinate derivate dal sistema tecnico di coordinate e da misure antropometriche del soggetto.
Un modello biomeccanico è una rappresentazione semplificata del sistema biologico, data la complessità del sistema da rappresentare; di solito ci riferiamo a un sistema di riferimento vincolato al sistema scheletrico.
PARAMETRI DINAMICI.
La dinamica è il ramo della meccanica che si occupa dello studio del moto dei corpi e delle sue cause o, in termini più concreti, delle circostanze che lo determinano e lo modificano, ed è regolata da tre principi o leggi:
- Legge I - Legge di inerzia di Galilei: Ciascun corpo persevera nel suo stato di quiete o di moto rettilineo uniforme, salvo che sia costretto a mutare quello stato da forze impresse
- Legge II - Legge di Newton: Il cambiamento di moto è proporzionale alla forza risultante motrice impressa, ed avviene lungo la linea retta secondo la quale la forza è stata impressa.
- Legge III - Ad ogni azione corrisponde una reazione uguale e contraria.
SISTEMI PER L’ANALISI DEL MOVIMENTO E SISTEMI
OPTOELETTRONICI.
Lo studio del movimento umano (attraverso la Gait Analysis) prevede la misura di variabili cinematiche (posizione, velocità e accelerazione) e dinamiche (forze), caratterizzanti il movimento dei segmenti anatomici durante un atto motorio. Per la misura delle grandezze cinematiche sono disponibili diversi sistemi. Gli elettrogoniometri e gli accelerometri, ad esempio, consentono di ottenere misure dirette di alcune delle variabili di interesse (misure angolari con i primi e accelerazioni con i secondi) grazie al contatto tra la superficie del corpo e il dispositivo elettrico; lo svantaggio è che essendo ingombranti possono ridurre la naturalezza del movimento, inoltre se si vogliono ottenere misure di posizioni e velocità integrando l’accelerazione bisogna tenere presente che viene integrato anche il rumore presente (effetto drift). Esistono anche sistemi basati su sensori elettromagnetici che sfruttano un generatore esterno di campo magnetico ma consentono misure poco accurate, sistemi basati su sensori acustici che a partire dalla velocità nota del suono dell’aria localizzano la posizione di una sorgente posta sul segmento anatomico. Questi ultimi sistemi sono difficilmente impiegabili a causa di interferenze ed echi difficilmente eliminabili.
Infine si possono utilizzare anche sistemi optoelettronici che utilizzano telecamere operanti nella gamma del visibile o dell’infrarosso che garantiscono una accuratezza elevata. Nonostante ciò essi non forniscono una misura diretta delle variabili cinematiche bens una loro stima. Questi sistemi si basano sull’uso di marcatori cooperativi posti sulla superficie corporea del soggetto le cui immagini acquisite da più telecamere sono ricostruite in tre dimensioni. I marcatori possono essere passivi o attivi. I primi sono costituiti da supporti di materiale plastico ricoperti da una pellicola catarifrangente, richiedono un dispositivo aggiuntivo d’illuminazione che opera nell’intorno di lunghezze d’onda specifiche (708-820 nm) e vengono riconosciuti come punti luminosi sulla scena una volta che le telecamere vengono dotate di un opportuno filtro ottico. I marcatori attivi, invece, sono costituiti da LED e generano autonomamente il segnale luminoso, ma la necessità di alimentazione e sincronizzazione via cavo ne riduce l’impiego a particolari applicazioni. Inoltre i marcatori passivi richiedono un sistema di preelaborazione affinchè siano identificati e sono caratterizzati da ampi angoli di riflessione; quelli attivi, invece, non necessitano di particolari procedure di preelaborazione ma hanno angoli di emissione inferiori tali da rendere critico il set-up delle telecamere per movimenti complessi.
I sistemi optoelettronici per l’analisi del movimento, sviluppati a partire dai primi anni Ottanta, utilizzano telecamere dotate di dispositivi per la rilevazione del segnale luminoso e la trasduzione in segnale elettrico quali i sensori CCD e CMOS. I sensori del primo tipo sono composti da una matrice di condensatori Mos nei quali viene accumulata carica proporzionalmente al numero di fotoni incidenti, successivamente la carica accumulata viene portata ad un circuito in lettura e convertita con un segnale analogico. Selezionato il pixel di interesse il segnale acquisito verrà portato ad un convertitore analogico-digitale per la conversione in una stringa di bit. I sensori CMOS hanno una struttura simile ai sensori CCD appena descritti, ma si discostano da questi in quanto ciascun pi el è collegato ad un convertitore analogico-digitale che permette di fornire direttamente in uscita un segnale di tipo digitale; inoltre questi sensori richiedono una circuiteria esterna ridotta ma riducono l’area sensibile del sensore stesso.
L’acquisizione delle prove di Gait Analysis del presente studio, sono state realizzate tramite l’utilizzo del sistema optoelettronico.
SISTEMI E PROTOCOLLI PER L’ACQUISIZIONE
Il sistema SMART-DX è un sistema di cattura del movimento (motion capture), basato su tecnologia ottica, progettato da BTS per uso biomeccanico e clinico. SMART-DX può eseguire la ricostruzione tridimensionale di traiettorie di un certo numero di piccoli marker riflettenti sul corpo del paziente. Con una serie di telecamere posizionate attorno al volume in cui verrà eseguita l'azione, il sistema acquisirà il movimento del soggetto; la posizione delle telecamere verrà definita grazie alla fase di calibrazione. Nel seguente studio, è stato utilizzato come sistema di acquisizione, il sistema SMART-DX progettato da Bts.
- NON INVASIVO: l'assenza di qualsiasi cavo consente una completa libertà di movimento. L'applicazione di alcuni piccoli marker passivi sul corpo del paziente consente la ricostruzione dell'attività di movimento in modo preciso e completo.
- FACILE DA USARE: SMART-DX è il primo sistema di cattura del movimento realizzato con l'obiettivo di concentrarsi sulla facilità d'uso di qualsiasi utente senza particolari conoscenze tecniche richieste: è sufficiente un'esperienza di base nell'utilizzo di un PC e di un ambiente Windows®.
- FACILE DA INSTALLARE: l'installazione di SMART-DX è facile come l'installazione di un dispositivo periferico come uno scanner o una stampante e non richiede l'assistenza di personale specializzato. SMART-DX può essere facilmente smontato, spostato e reinstallato in pochissimo tempo.
- CALIBRAZIONE RAPIDO LUMINOSO: la calibrazione del sistema è un'operazione facile e veloce. In soli cinque minuti, una sola persona può eseguire la procedura ogni volta che è necessaria, consentendo la massima precisione per tutto il tempo. La calibrazione del sistema non richiede di mettere le telecamere su un banco come fanno molti altri sistemi di cattura del movimento.
Equipaggiamento standard:
- Fino a 16 telecamere digitali a infrarossi;
- Datastation (Workstation) con software installato;
- Monitor LCD;
- Supporto telecamera;
- Kit di calibrazione Thor;
Oltre alle telecamere a luce infrarossa intelligenti, ad alta frequenza e risoluzione, alle pedane di forza digitali e all’elettromiografo wireless, il sistema è dotato di una serie di protocolli clinici validati dalla Comunità Scientifica Internazionale. Ciascun protocollo consente ai medici di valutare la mobilità articolare, l’attività muscolare e la distribuzione della forza sul piano durante il cammino del paziente. I protocolli forniscono un report multimediale contenente grafici e parametri spazio-temporali, cinematica e cinetica delle articolazioni durante le varie fasi del ciclo del passo. Sono inoltre forniti dei riferimenti di normalità per alcune delle variabili analizzate. Il confronto con questi riferimenti può essere utile per ottenere una comprensione completa delle strategie motorie compensative sui diversi piani del corpo e identificare i follow-up più efficaci.
- "Protocolli tecnici": comportano il posizionamento di cluster di materiale riflettente, marcatori, (almeno tre per la definizione di un sistema di riferimento) in posizioni non corrispondenti a punti anatomici. Ogni cluster identifica un sistema tecnico di riferimento relativo al segmento corporeo su cui è stato posizionato, ma diverso dal sistema di riferimento anatomico del soggetto. Il grappolo è vincolato con strisce elastiche o sistemi di fissaggio. Poiché il sistema di riferimento tecnico non coincide con il sistema anatomico di riferimento, l'uso di questi protocolli comporta inoltre una fase di calibrazione (diversa dalla calibrazione del sistema optoelettronico, che dovrebbe sempre essere comunque effettuata) prima dell'acquisizione del gesto motorio definire le relazioni tra questi due sistemi di riferimento. Il protocollo tecnico più conosciuto è la Calibrated Anatomical System Technique, o CAST [Cappozzo, 1995 e 1996] insieme al più recente protocollo sviluppato presso l’Istituto Ortopedici Rizzoli (IOR) di Bologna [Leardini, 2007].
- Protocolli "anatomici": richiedono il posizionamento di marker sulla pelle del soggetto in corrispondenza di determinati punti di riferimento, ovvero punti in cui vi è un facile riferimento alla struttura scheletrica. I marker devono essere posizionati in punti facilmente identificabili per consentire un posizionamento ripetibile; di solito questi punti sono in corrispondenza di protuberanze scheletriche, facilmente identificabili con la palpazione. Questi protocolli non richiedono la calibrazione aggiuntiva per la definizione della relazione tra sistemi di riferimento tecnici e anatomici, che è invece necessaria nel caso di protocolli tecnici. Algoritmi che utilizzano le misure antropometriche del soggetto in esame calcolano i centri articolari. I protocolli anatomici più usati sono i Davis, Gage [Davis, 1991; Ounpuu, 1991], Helen Hayes o Kadaba [Kadaba, 1990], protocollo SAFLO [Frigo, 1998] e protocollo Lundberg [Halvorsen, 1999].
Il protocollo usato per lo studio è stato il Davis.
REGISTRAZIONE DEL PAZIENTE E IDENTIFICAZIONE DEI PUNTI DI REPERE.
La registrazione del paziente prevede la compilazione di una scheda anagrafica, contenente i dati relativi a sesso, età, statura e peso e altre misure antropometriche che verranno elencate di seguito.
- IDENTIFICAZIONE DELLE SIAS: viene posto il paziente supino, possibilmente su una superficie rigida, e si marca con una matita dermografica. (figura 1.5)

Figura 1.5
- MISURAZIONE DELLA DISTANZA DELLE SIAS: con il paziente in posizione supina, si misura da apice a apice con il pelvimetro. (figura 1.6)

Figura 1.6
- IDENTIFICAZIONE DEL GRANDE TROCANTERE: il paziente posto in posizione supina, l’anca è in massima flessione ed intrarotazione, si effettua una manovra di palpazione, dopo di che l’arto torna in posizione neutra. (figura 1.7)

Figura 1.7
- IDENTIFICAZIONE DEL PIANO DEL TROCANTERE: il paziente posto in posizione supina, identifico il piano del trocantere con il goniometro parallelo alla superficie rigida. (Figura 1.8)

Figura 1.8
- MISURA PROFONDITA’ BACINO: paziente in posizione supina, con il goniometro centrato sul trocantere a 90°, si misura la distanza con le SIAS. (figura 1.9)

Figura 1.9
- MISURAZIONE LUNGHEZZA AAII: il paziente in posizione supina con il ginocchio esteso, si misura dalla SIAS all’apice del malleolo mediale, passando per la porzione mediale della rotula. (Figura 1.10)

Figura 1.10
- IDENTIFICAZIONE CONDILI FEMORALI: il paziente in piedi o seduto, a ginocchio flesso si palpano i condili e si traccia una linea con la matita dermografica. ( Figura 1.11)

Figura 1.11
- MISURA LARGHEZZA GINOCCHIO: il paziente in piedi o seduto con il ginocchio flesso, viene misurata la distanza fra i condili, attraverso il pelvimetro. (Figura 1.12)

Figura 1.12
- IDENTIFICAZIONE MALLEOLI: il paziente in piedi o seduto, con la tibio- tarsica posta a 90°, si palpa l’apice dei malleoli e si marca con una matita dermografica. (Figura 1.13)

Figura 1.13
- MISURA LARGHEZZA CAVIGLIA: il paziente in piedi o seduto, con la tibio-tarsica a 90°, si misura da apice a apice con il pelvimetro. ( Figura 1.14)

Figura 1.14
MARKERIZZAZIONE
Utilizzando i marker sferici, con il paziente in piedi, iniziamo la markerizzazione secondo il protocollo Davis così come modificato da Heel. Facendo flettere ed estendere il collo al paziente identifichiamo la vertebra C7 che appare come la più prominente. Successivamente posizioniamo 2 marker sugli acromion. Procediamo poi a markerizzare le SIAS. Applichiamo un marker sulla seconda vertebra sacrale identificata come il punto medio tra le SIPS. Per avere un’indicazione circa il corretto posizionamento dei marker del bacino bisogna guardare il soggetto a figura interna in proiezione sagittale e verificare che la congiungente fra il marker delle SIAS e quello sacrale formi un angolo di 90° con il tratto lombare. Si procede quindi a markerizzare il trocantere ed i condili femorali laterali precedentemente identificati. A circa metà coscia si posizionano le barre lunghe e si allineano con i marker del trocantere e quelli del condilo femorale. Dal momento che la posizione della barra è di fondamentale importanza per l’identificazione dell’asse di rotazione del ginocchio, si verifica questo allineamento con una livella laser. Si identifica e markerizza la testa del perone quindi gli apici dei malleoli laterali. Con le stesse accortezze delle barre di coscia si posizionano le barre di gamba e se ne verifica l’allineamento con la livella laser dal momento che il loro orientamento svolge un ruolo fondamentale nell’identificazione del corretto asse di flesso-estensione della caviglia. Sempre con la livella laser si verifica che la congiungente fra i marker metatarsali e quello calcaneare sia parallela alla superficie d’appoggio del paziente. (Figura 1.15)

Figura 1.15
Il bacino
Il piano che rappresenta il bacino è dato dai marcatori posizionati sulla vertebra sacrale e su ogni spina iliaca anteriore (SIAS). ( Figura 1.16)

Figura 1.16
Il sistema anatomico di riferimento del bacino viene definito utilizzando come origine il punto mediale tra la SIAS destra e sinistra (Fig. 1.15) L'asse antero-posteriore inizia dal punto mediale delle spine iliache posteriori sinistra e destra all'origine (Fig. 1.16). L'asse mediale-laterale parte dalla SIAS destra alla SIAS sinistra (Fig. 1.17) e l'asse longitudinale è perpendicolare al piano formato dagli altri due assi (Fig. 1.18).
Gli angoli del bacino, essendo riferiti al sistema di riferimento del laboratorio, sono angoli assoluti.

Figura 1.17

Figura 1.18
La coscia
Il piano della coscia è definito posizionando un marcatore sul grande trocantere, uno sul condilo laterale femorale ed uno su una barra legata alla coscia con una striscia elastica (la posizione della barra è regolata in modo tale che sia nel piano definito dal centro dell'anca e dall'asse del ginocchio) (Fig. 1.19). La posizione del centro dell'articolazione dell'anca è fissa in relazione alla posizione del bacino.

Figura 1.19
Il sistema di riferimento anatomico della coscia (figura1.20) è allineato in modo che l'asse longitudinale della coscia sia parallelo all'asse biomeccanico del femore (dal centro dell'articolazione del ginocchio al centro dell'articolazione dell'anca) (Fig. 1.20). L'asse mediale-laterale è perpendicolare all'asse longitudinale del piano che contiene l'asse longitudinale (quindi i centri di ginocchio e anca) e l'asse di estensione della flessione del ginocchio (Fig. 1.22). L'asse antero-posteriore è perpendicolare al piano che contiene i centri di ginocchio e anca e l'asse di estensione della flessione del ginocchio (Fig. 1.23).
![Figura 1.20: Anatomical system of reference of the thigh [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_024.jpg)
Figura 1.20: Anatomical system of reference of the thigh [Modified by Gage, 2004].
![Figura 1.21 : The intra-extrarotation movement of the hip is around the longitudinal axis. [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_025.jpg)
Figura 1.21 : The intra-extrarotation movement of the hip is around the longitudinal axis. [Modified by Gage, 2004].
![Figura 1.22: The flex-extension movement of the hip is relative to the medial-lateral axis. [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_026.jpg)
Figura 1.22: The flex-extension movement of the hip is relative to the medial-lateral axis. [Modified by Gage, 2004].
![Figura 1.23: The ab-adduction movement is done relative to the anterior-posterior axis. [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_027.jpg)
Figura 1.23: The ab-adduction movement is done relative to the anterior-posterior axis. [Modified by Gage, 2004].
La gamba
Il piano della gamba viene definito posizionando un marker sull'epicondilo laterale, uno sul malleolo laterale e un terzo marker posizionato su una barra vincolata alla gamba e che si trova nello stesso piano del centro dell'articolazione del ginocchio e dell'asse dell'articolazione della caviglia (Fig. 1.24). Il centro dell'articolazione del ginocchio viene definito utilizzando i marker posizionati sulla coscia come descritto in precedenza e viene calcolato in base alla larghezza del ginocchio nel piano coronale.
![Figura 1.24: Plane representative of the leg. [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_028.jpg)
Figura 1.24: Plane representative of the leg. [Modified by Gage, 2004].
Il sistema anatomico di riferimento della gamba è simile a quello della coscia (Fig. 1.25) e l'asse di flessione della caviglia, il centro dell'articolazione della caviglia e il centro dell'articolazione del ginocchio sostituiscono rispettivamente l'asse di flessione del ginocchio, il centro dell'articolazione del ginocchio e il centro dell'articolazione dell'anca. Il movimento del ginocchio è principalmente nel piano sagittale e quindi è considerato come se l'articolazione del ginocchio avesse solo un grado di libertà. L'asse longitudinale va dai centri dell'articolazione della caviglia al centro dell'articolazione del ginocchio (Fig. 1.26); il piano coronale della tibia contiene i centri articolari dell'anca, del ginocchio e dell'asse di flessione del ginocchio o della caviglia (Fig. 1.27).
![Figura 1.25 : Anatomical system of reference of the tibia segment [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_029.jpg)
Figura 1.25 : Anatomical system of reference of the tibia segment [Modified by Gage, 2004].
![Figura 1.26: The flex-extension movement of the knee is relative to the medial-lateral axis of the tibia. [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_030.jpg)
Figura 1.26: The flex-extension movement of the knee is relative to the medial-lateral axis of the tibia. [Modified by Gage, 2004].
![Figura 1.27: The varus-valgus movement of the knee is around the anterior-posterior axis of the tibia. [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_031.jpg)
Figura 1.27: The varus-valgus movement of the knee is around the anterior-posterior axis of the tibia. [Modified by Gage, 2004].
Il piede
Si posiziona un marker sulla testa del 5° metatarso (r met – l met) e un marker sul tallone (r heel – l heel). È importante che i due marker siano allineati. Per un posizionamento corretto, guardare il soggetto sagittalmente e verificare che i marker su 5° metatarso e tallone siano alla stessa altezza in modo da identificare una linea parallela al piano della pianta del piede.
![Figura 1.28: Line representative of the foot [Modified by Gage, 2004].](https://www.neuropsicomotricista.it/images/stories/tesi-di-laurea/serena-chierisini/Image_032.jpg)
Figura 1.28: Line representative of the foot [Modified by Gage, 2004].
Per la valutazione dell’attività elettrica muscolare è necessario applicare due elettrodi su ciascun muscolo da analizzare. Per il corretto posizionamento degli elettrodi fare riferimento alle linee guida più diffuse e riconosciute in letteratura (Cram et al. 1998, Merletti 2000). Nella fase di preparazione del soggetto è assolutamente necessario prestare attenzione alla corrispondenza che si va a stabilire tra il numero della sonda e il muscolo.
FASE DI ACQUISIZIONE
- Prova di standing: il soggetto deve rimanere fermo in posizione ortostatica per almeno 3 - 5 secondi. È importante che i piedi del soggetto siano allineati uno con l’altro, evitando cioè che un piede risulti in posizione anteriore o posteriore rispetto all’altro. Nel caso sia disponibile una piattaforma di forza, il paziente può eseguire la prova su quest’ultima.
- Prova di Walking: il soggetto deve camminare in maniera naturale attraverso il volume di lavoro definito in fase di calibrazione del sistema optoelettronico. In presenza del camminatoio, per il soggetto diventa più semplice seguire una direzione di cammino. Diversamente, accertarsi che il soggetto esegua la camminata nel modo più lineare possibile. Inoltre, è necessario controllare che i marker posizionati sul soggetto siano sempre ben visibili dalle telecamere lungo tutto il percorso. Se sono disponibili una o più piattaforme di forza, per poter effettuare l’analisi dinamica è necessario che il soggetto esegua l’intera fase di appoggio del singolo piede su una delle piattaforme disponibili. È importante non forzare il soggetto a camminare in modo da ottenere tale risultato, poiché ciò lo porterebbe a modificare il suo naturale pattern di cammino. L’appoggio del piede sulla piattaforma di forza deve avvenire in modo spontaneo.
Il protocollo richiede un’unica acquisizione della prova di Standing e almeno un’acquisizione della prova di Walking.
FASE DI ELABORAZIONE
- Tracking: è necessario prima di tutto eseguire il “tracking” dei marker, ovvero assegnare a ciascun marker, in ogni istante temporale, la corrispondente etichetta sulla base della reale posizione del marcatore. In entrambe le versioni del protocollo questa operazione viene eseguita automaticamente. Si consiglia, tuttavia, di verificare che l’etichettatura sia stata eseguita correttamente per l’intera durata dell’acquisizione. Per eseguire l’analisi dei momenti e delle potenze articolari, inoltre, è necessario eseguire il “tracking” dei vettori di forza (se disponibili). Ciò significa che ciascun vettore deve essere associato all’etichetta corrispondente al piede che è entrato in contatto con la relativa piattaforma.
Una volta avviata l’elaborazione, verrà richiesto di definire i seguenti eventi del cammino:
- eRHS = Appoggio piede dx – Contatto iniziale del piede destro con il suolo (devono essere definiti almeno due eventi).
- eRTO = Distacco piede dx – Distacco delle dita del piede destro dal suolo (un evento all’interno di ciascun intervallo definito dalla coppia di eventi di appoggio identificati precedentemente).
- eLHS = Appoggio piede sx – Contatto del piede sinistro col suolo (devono essere definiti almeno due eventi).
- eLTO = Distacco piede sx – Distacco delle dita del piede sinistro dal suolo (un evento all’interno di ciascun intervallo definito dalla coppia di eventi di appoggio identificati precedentemente).
FASE DI REFERTAZIONE
I risultati dell’elaborazione sono pronti per essere visualizzati nel report. Per creare un report è necessario fornire i dati normativi per la cinematica, la dinamica e l’attività elettromiografica. A seconda dell’età del soggetto analizzato è possibile scegliere tra due fasce di normalità predefinite: “Cammino-Normale-adulti” e “Cammino-Normale-bambini”.
Il report clinico finale utilizzato per lo studio è così composto:
- La prima pagina contiene i parametri spazio-temporali mediati su tutte le acquisizioni selezionate in “Prove da reportare o visualizzare”. Questi parametri vengono visualizzati a fianco dei dati normativi. Nella stessa pagina sono riportati i valori dei parametri cinematici misurati durante la prova di Standing e l’elenco delle acquisizioni utilizzate per l’analisi statistica.
- Nella pagina successiva sono presentati due indici sintetici che riassumono la “qualità” complessiva (dal punto di vista cinematico) del cammino del soggetto. Questi indici facilitano il confronto tra un cammino normale e uno patologico.
- Il Gait Profile Score (GPS) è calcolato come la distanza Euclidea tra le curve cinematiche caratteristiche del cammino del paziente, e le corrispondenti curve caratteristiche di soggetti normali appartenenti al cosiddetto “gruppo di controllo”. Valori superiori ai 7° del GPS indicano un pattern di cammino compromesso.
- I Gait Variable Score (GVS) sono calcolati come lo scarto quadratico medio tra la singola curva caratteristica del paziente e la corrispondente curva caratteristica media del gruppo di controllo. I GVS sono calcolati per ogni curva cinematica caratteristica e vengono mostrati in una specifica tabella. Questa tabella permette di osservare quali parametri contribuiscono a determinare un GPS elevato.
- Il Gait Deviation Index (GDI) può essere interpretato nel modo seguente: un GDI≥100 indica un soggetto i cui parametri cinematici caratteristici del cammino sono statisticamente indistinguibili dagli stessi parametri del gruppo di controllo. In altre parole un GDI≥100 indica un soggetto normale.
- I grafici dell’analisi cinematica, riportano le rotazioni in gradi (asse delle ordinate) rispetto alla percentuale del ciclo del passo (asse delle ascisse). Le curve medie per ciascun arto (verdi per l’arto destro e rosse per l’arto sinistro) sono tracciate rispetto alle fasce di normalità (in grigio). Le linee verticali tratteggiate identificano l’evento di distacco del piede, mentre le linee orizzontali continue rappresentano i valori della prova di Standing. Tali linee sono anch’esse verdi o rosse a seconda che si riferiscano rispettivamente all’arto destro o sinistro.
- I risultati dell’analisi dinamica vengono presentati nelle pagine seguenti, con lo stesso schema utilizzato per i risultati della cinematica. Per favorire una corretta interpretazione dei momenti e delle potenze relativi ai giunti articolari, all’inizio della pagina sono mostrate le rotazioni di anca, ginocchio e caviglia nel piano sagittale (gradi). Tutti i dati vengono visualizzati rispetto alla percentuale del ciclo del passo (asse delle ascisse). I momenti e le potenze alle articolazioni sono visualizzati in rapporto al peso del soggetto, e quindi rispettivamente in Newton*metro/kg e Watt/kg. Le forze di reazione vincolare sono visualizzate in percentuale al peso corporeo.
- Nelle ultime pagine sono mostrate le attività elettromiografiche dei muscoli, riportate in millivolt.





































